 BTC/HKD-0.74%
BTC/HKD-0.74% ETH/HKD-2.62%
ETH/HKD-2.62% LTC/HKD-2.45%
LTC/HKD-2.45% ADA/HKD-1.81%
ADA/HKD-1.81% SOL/HKD-2.91%
SOL/HKD-2.91% XRP/HKD-3.53%
XRP/HKD-3.53%《科創板日報》訊,“一次性納入7款罕見病用藥”;“原價70萬一針的天價罕見病用藥一舉降至3萬3”;剛剛過去不久的藥圈年度盛事—2021年國家醫保目錄談判再次帶火了罕見病用藥。
而與之形成鮮明對比的是,一周之后,當罕見病“獨角獸”北海康成-B正式登陸港交所,上市首日公司卻大跌了近30%。
市場并沒有“用腳投票”。因為讓罕見病患者用得起藥,實現罕見病藥的患者是一項系統性工程,解決支付難題僅僅只是其中一環。而在如何做好罕見病藥這個問題上,包括北海康成在內的這個領域的所有企業,仍待闖出一條切實可行的路子來。
一款罕見病新藥以創紀錄速度實現可及的啟示
罕見病,往往是指那些發病率極低的疾病。根據世界衛生組織的定義,罕見病為患病人數占總人口的0.65‰~1‰之間的疾病或病變。目前全球已知罕見病約7000種,約占人類疾病的10%,而在這些種類繁多的罕見病當中,有約80%是由基因缺陷所導致。
由于罕見病單一病種患病率低,單一病種藥物市場需求量很小,因此制藥企業很難有足夠的動力去研發相關藥物,這就導致現階段針對罕見病的治療手段和藥物均較為有限。有統計顯示,在全球已知的約7000種罕見病中,真正有藥可用的疾病大概只占到了5%-10%左右。
因此,罕見病一直是全人類的挑戰,而各國也都為此在積極尋求各自的解決之道。
美國是全球首個通過關于罕見病用藥法案的國家,在1983年頒布了《孤兒藥法案》。該法案在經濟上對罕見病研發進行了激勵,包括對研發成本的50%給予稅收抵免、設置孤兒藥專營權排他性條款等,為此后各國罕見病治療藥物政策的研究作出指引。
在2017年6月,美國又發布了《孤兒藥現代化計劃》,旨在解決孤兒藥產品項目審批大量積壓的問題。該計劃提出90天內對超過120天的所有請求進行完整審核,并要求之后的所有新孤兒藥認定時長控制在90天以內,從而加速孤兒藥的審批上市。
中國大概是從2018年左右起,開始加速完善罕見病領域內的藥品研發與審批等相關政策。
元宇宙產業大會2023年春季會將于明日召開 重點聚焦ChatGPT與元宇宙的關系:金色財經報道,2月15日-17日,元宇宙產業大會2023年春季會將于江蘇昆山舉行,大會將重點聚焦ChatGPT與元宇宙的關系。據介紹,2月16日-17日,會上將有12位來自國內外的兩院院士發表主題演講,40多位元宇宙上下游龍頭企業分別從文旅元宇宙、城市元宇宙等角度分享真知灼見。[2023/2/14 12:05:54]
2018年5月22日,國家衛生健康委員會、科技部、工業和信息化部、國家藥品監督管理局、國家中醫藥管理局等五部門聯合發布了《第一批罕見病目錄》,共收錄121種罕見病。
這是中國首次官方定義罕見病,也是中國罕見病管理的一個里程碑式事件。有了這一份目錄,中國罕見病診療體系的建設、罕見病的基礎研究、罕見病用藥的上市、研發及醫療保障就有了重要的參考依據。目前,第二批目錄的制定也正在推進中。
藥物注冊審批方面,國家藥監局在2018年及2019年分兩次共推出了78種境外已上市臨床急需新藥名單,其中包括37種罕見病藥物。列入名單的藥品可通過提交境外研究資料,直接提出上市申請并納入優先審評程序。
對于絕大多數人來說,這些政策出臺的意義可能陌生又遙遠,但對于罕見病患者來說感受卻可能截然不同。
在今年10月舉辦的“浦江醫藥健康產融創新發展峰會”上,中國罕見病聯盟執行理事長、中國醫院協會副會長李林康便提及了這樣一個案例:
氘丁苯那嗪,這是一個治療亨廷頓舞蹈癥的藥物,由以色列梯瓦制藥公司所研發。
氘丁苯那嗪于2017年4月獲美國FDA批準上市,是近幾十年來繼丁苯那嗪之后,FDA批準的第2個用來治療與HD有關的舞蹈病的新藥。氘丁苯那嗪是丁苯那嗪的氘取代產物,也可以看作是后者的改良新藥。
此前,由于丁苯那嗪一直未在國內上市,國內HD患者長期以來一直都面臨無藥可用的困境。因此在后來,有患者及公益組織就嘗試聯系了生產企業,希望企業能夠將這款藥物引入中國。但考慮到病人數量有限,加上上市注冊審批等各方面的成本較高,企業選擇了放棄。
火幣大學于佳寧:北京最新政策明確新基建聚焦的六大方向:6月23日20:00,火幣大學校長于佳寧在火幣大學直播間,以“從北京最新區塊鏈政策看全國區塊鏈政策風向 “為主題正在進行在線直播大課。
于佳寧表示,新基建是整個中國今年的重中之重,北京政策是全國各地政策的風向標。北京最新發布的政策中,明確新基建聚焦六大方向,分別是新網絡(網+云+鏈+邊+端)、新要素(算力、數據、普惠AI)、新生態、新平臺、新應用、新安全。發展新基建有助于構建服務平臺、提升服務能力,其中推進區塊鏈服務平臺和數據交易設施建設,也是北京發展區塊鏈的核心關鍵所在。區塊鏈的應用主要圍繞著數據共享和交易、數字身份、智慧醫療、電子政務、金融服務等領域展開。所以判斷項目是否符合新基建,主要看是否涉及這六個方向的內容。[2020/6/23]
相較之下,氘丁苯那嗪就幸運得多。在美國獲批之后,隨即在2018年11月入選國家藥監局《第一批臨床急需境外新藥名單》。這意味著,這款藥物如果要在中國上市的話,可以享受到優先審評的便利,能夠大大降低藥品上市的時間成本。
2019年12月27日,梯瓦氘丁苯那嗪片正式在中國遞交新藥上市申請,并火速在次年5月獲批,成為中國首個治療HD的藥物。
從公開信息看,以當時氘丁苯那嗪片在美國的價格換算,一盒藥的價格在3萬多元人民幣左右,但一盒藥只能吃100天,因此患者每個月的用藥費用高達萬元,這讓很多家庭都無力承擔。
因此,闖過“上市關”之后,能否被盡快納入醫保,同樣會在很大程度上決定這款救命藥是否可以惠及更多病人。
也就是在氘丁苯那嗪獲批的這一年,繼將國家醫保目錄調整的頻率由此前的數年一次增至每年一次以后,國家醫保局又對醫保目錄調整方案作出了另一項重大改變。
在以往醫保目錄的調整中,創新藥的準入門檻一般是截至上一年的年末,因此談判當年新批準上市的藥物只能等到下一次醫保目錄調整。而這一年,醫保局首次把這個時間準入門檻擴大至方案公布之日。
“主要是希望對于那些剛剛獲批的創新藥,特別是擁有自主知識產權的創新藥,給予更快的醫保目錄準入機會,同時也讓參保人能夠盡早用上有更好臨床價值的創新藥,盡快從目錄調整中受益。”國家醫保局醫藥服務管理司相關負責人在接受媒體采訪時表示。
防范非法集資宣傳月啟動 主要聚焦虛擬貨幣、區塊鏈等行業領域:日前,記者從河北省張家口市銀保監分局獲悉,為進一步加強防范非法集資宣傳教育,提升人們風險防范意識,推進非法集資源頭治理,2020年6月以“守住錢袋子·護好幸福家”為主題的防范非法集資宣傳月活動已在張家口全市金融機構啟動。本次主題活動將聚焦網絡借貸、私募基金、養老服務、虛擬貨幣、區塊鏈、電子商務等行業領域,注重防范利用疫情、復工復產等噱頭開展非法集資風險。據悉,活動內容主要包括普及金融知識、加強風險警示教育,以及引導正確維權。(張家口新聞網)[2020/6/3]
也因此,在2020年5月獲批的氘丁苯那嗪獲得了參加當年醫保談判的入場券,并且因為報價合適被順利納入。
以往一款新藥從申報上市到獲批,再到取得醫保支付資格,通常需要數年甚至更長時間,而氘丁苯那嗪只花了1年左右的時間,這是史無前例的速度。
在業內看來,這折射出中國罕見病領域政策環境的巨大變化,同時又是政策制定部門、企業、患者自身、公益組織以及醫生等多方共同努力的結果。
支付難題,就已經不存在了嗎?
雖然政策環境在持續改善,但在現階段罕見病藥物的開發與可及仍然要面臨種種問題,包括疾病診斷困難、因為患者人數少臨床試驗推進不易等,但其中最受關注的還是支付矛盾。
據有關研究,罕見病藥是目前耗時最多、需要勞動量最大和最為資源密集型的藥品,因此其成本和售價都相對高昂,超出了大部分患者的支付能力。在中國,這些患者只能將希望寄托于醫保之上。
今年的國家醫保目錄調整新增了7個罕見病用藥,其中還有多個高值罕見病藥,包括因“天價”屢上熱搜的渤健的諾西那生鈉注射液、武田的阿加糖酶α注射用濃溶液、輝瑞氯苯唑酸軟膠囊等,實現了高值罕見病用藥進入醫保“零的突破”。
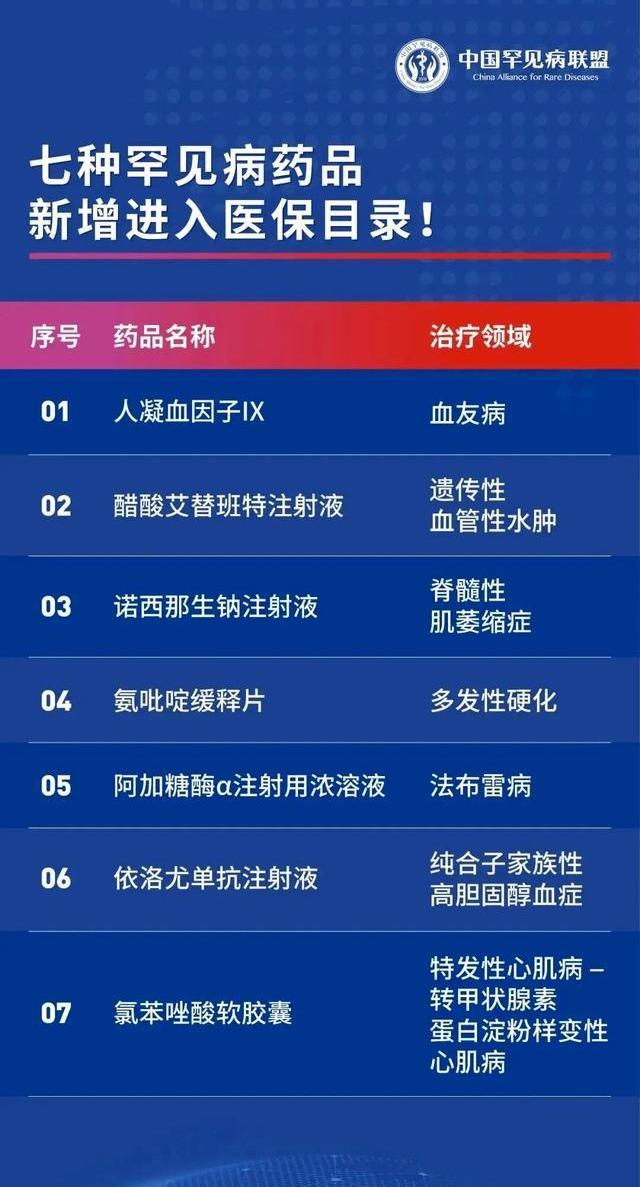
圖|今年被納入醫保的7個罕見病藥
動態 | 煙臺聚焦突破區塊鏈等重點領域 打造全國農業數字化先行區:據煙臺財經網消息,煙臺市《數字山東發展規劃(2018-2022年)》已于近日出臺。為建設數字山東, 《規劃》聚焦建設數字政府、發展數字經濟、構建數字社會三大任務,推動經濟社會各領域數字化轉型發展。數字經濟方面,山東省將圍繞核心引領、前沿新興、關鍵基礎、高端優勢四大領域,聚焦突破大數據、云計算、人工智能、區塊鏈等重點領域,打造全國智能制造標桿和服務業、農業數字化先行區。[2019/3/24]
“7款罕見病藥物納入醫保目錄,對醫藥企業針對罕見病相關領域的創新研發將起到正向的激勵作用,傳遞了利好的信號。我們相信未來,罕見病領域會得到更多的關注,更多患者的治療需求將被發掘,海外上市新產品將加速引進中國,也會有更多創新企業加速相關領域研發,以幫助更多的罕見病患者獲得應有的、規范的治療。”在談判結果公布之后,輝瑞方面這樣向《科創板日報》記者表示。
不過,雖然今年罕見病藥醫保談判斬獲頗豐,但需要指出的是,國家醫保對罕見病藥物的覆蓋并不是從今年才開始。在2019年、2020年的醫保目錄調整中,已分別有9個和7個罕見病藥物被納入醫保。
另據罕見病公益組織—北京病痛挑戰公益基金會統計,截至目前,基于國家《第一批罕見病目錄》,在我國明確注冊的罕見病適應癥藥品有87種,涉及46種罕見病;截至2021年國家醫保談判之后,有28種罕見病的58種藥物已納入國家醫保目錄中。
據此推算,國家醫保對《第一批罕見病目錄》所涉及罕見病藥物的覆蓋已經超過60%。
與此同時,我們也需要看到,一款天價藥最終能以平價藥的身份列入醫保,并不等同于醫保已對高值用藥“開閘”。
醫保作為基本醫療保險,具有普遍性、廣覆蓋、保基本的特點,這就決定了進入國家醫保目錄的藥品首先需要滿足的一個條件就是“價格合理”。
“在調整中,國家醫保局牢牢把握‘保基本’的功能定位,將基金可承受作為必須堅守的‘底線’,防止天價藥、昂貴藥進醫保。”國家醫保局醫藥服務管理司司長黃華波曾明確表示。
中遠海運集團董事長許立榮:當前物流業發展理念聚焦于區塊鏈等新技術新載體 : 中遠海運集團董事長許立榮在4月9日舉行的博鰲亞洲論壇2018年年會“物流的變革”分論壇上表示,當前物流業的發展理念突出地體現為“兩個聚焦”:一個是創新理念不再聚焦于傳統要素,而是“聚焦”于區塊鏈、新能源、航運電商等新技術、新載體。另一個是服務理念不再聚焦于單一要素、自有要素,而是“聚焦”于一站式、集成化、全程服務。縱向整合、跨界合作、集群競爭正在成為業界共識。[2018/4/10]
“按照限定的支付范圍,目前國家醫保目錄內所有藥品年治療費用均未超過30萬元。”醫保談判結束后,在12月初的新聞發布會上,國家醫保談判藥品基金測算專家組組長鄭杰則透露了這樣一條醫保藥物的“價格基準線”。
雖然降價對于企業來說,可能在任何時候都不會是一個容易的決定。但在今年,渤健還是以黑馬之姿,一舉將諾西那生鈉注射液打至地板價,以換取進入醫保的機會。
諾西那生鈉注射液在國內獲批上市之初每單位定價高達70萬元,一年治療費用高達數百萬元。在今年的醫保談判中,其最初報價是53680元,后經過數次調整,最終降到33000元。
按照諾西那生鈉首年注射6次,降價后患者首年治療費用將降至20萬元左右。再以70%-80%的報銷額度計算,則患者只需自付4萬-6萬元左右。此后,患者每年只需注射3次,則每年的治療費用進一步減至10萬元左右。
對此,有業內人士認為,諾西那生鈉談判成功的關鍵還是,當醫保伸出橄欖枝的時候,“企業及時握住了”,雙方均是誠意滿滿。
“對醫保來說,有支持符合條件的罕見病藥品按規定納入醫保支付范圍的誠意;對渤健來說,公司同樣有給患者提供可及和可持續治療的誠意,所以選擇將價格降到位。”對方這樣向《科創板日報》記者表示。
而促使渤健在價格上作出大幅讓步的一個重要原因就是來自羅氏的競爭。
公開信息顯示,羅氏利司撲蘭口服溶液已經在今年6月16日進入中國市場,這是全球首個治療脊髓性肌肉萎縮癥的口服藥物。
“渤健諾西那生鈉需要鞘內注射給藥,也就是說要進行腰椎穿刺,這對于病人來說是比較痛苦的;相較之下,羅氏利司撲蘭是口服藥物,患者依從性更佳。價格方面,目前利司撲蘭在中國的定價是60mg/瓶零售價6.38萬元,加上贈藥,年費用65萬元,與醫保談判前諾西那生鈉的治療費用相當。諾西那生鈉在價格上沒有明顯優勢,依從性又不如利司撲蘭,競爭壓力會比較大,因此降價在所難免。”據前述業內人士表示。
中國的罕見病藥,到底該怎么做?
與大多數人理解的不一樣,罕見病藥除了那些高值的天價藥以外,其實還有很多平價藥以及一些低價的“保供藥”。
而連接天價和平價的可以說是“情懷”。
一般而言,天價藥需要解決的是部分罕見病患者“無藥可醫”的需求,但藥物的研發及商業化之難注定這會是一條布滿荊棘的道路,企業明知山有虎還向虎山行,很多時候靠的可能就是一份情懷;
“保供藥”雖樸實無華,解決的往往是罕見病患者的基本用藥需求,但因為價格低廉,甚至有可能還無法覆蓋企業成本,因此“保供”也就成了一種情懷。
以上藥生產的“保供藥”青霉胺片為例,100片的價格是79元,算下來一片只要0.79元,患者一年的藥費在2300元左右,并且青霉胺片還屬于甲類醫保,也就是說患者可100%進行醫保報銷。青霉胺片是治療肝豆狀核變性的一線用藥,預計每年至少可以惠及5000名患者。
不過,據《科創板日報》記者了解,由于目前青霉胺片更多時候是以低于生產成本的售價在銷售,加上病患人數有限,這款藥品一年僅能給企業帶來1000多萬的銷售額。這樣的產品雖然能解病人之急,但還遠遠不足以回哺企業。
情懷很可貴,但顯而易見在當前的市場環境下,只有情懷的中國罕見病藥物發展之路不僅會越走越難,也不可持續,而這正是擺在“北海康成”、“上藥”們眼前的問題。
作為較早扎根罕見病新藥研發的本土明星企業,北海康成有很多讓人稱道的地方,包括擁有快速引進外部項目的能力、得到了藥明康德和啟明創投等一眾知名投資人的認可、還建立了一支涵蓋10多個產品的豐富產品管線等。
但即便如此,公司港股上市后的股價仍是一路下跌。
“北海康成已上市產品賣得并不好。”對此,一位一級市場的投資人這樣向《科創板日報》記者指出,“由于國內罕見病患者支付能力有限、商保和醫保的覆蓋度又還不夠高,導致目前罕見病藥物在國內銷售額不佳、產品管線價值無法支撐企業估值。”
“因此,除細胞與基因治療等創新技術外,國內一級市場對罕見病的投資相對會非常謹慎。而細胞與基因治療能被看好的原因是,這些創新技術雖然在目前主要聚焦于罕見病領域,但未來技術成熟以后,還能夠在大病種上應用。”他并表示。
公開資料顯示,北海康成三款國內已上市產品康普舒、賀儷安和海芮思,分別于2018年11月、2020年4月及2020年9月獲批上市。
其中,海芮思是北海康成在國內成功商業化的第一個罕見病藥物,主要用于黏多糖貯積癥Ⅱ型的長期酶替代治療。據《科創板日報》記者了解,以這款罕見病藥目前在國內的售價計算,其一年的治療費用在百萬以上。

而從北海康成招股書來看,這3個產品的上市雖然對公司收入增長有一定的拉動作用,但整體銷售較之其他非罕見病藥物還是“小巫見大巫”。與此同時,由于其余在研產品的推進又需要巨大的研發投入,導致公司業績持續虧損。
北海康成在2019年、2020年的營收分別為147萬元、1203萬元;期內虧損分別為2.17億元、8.46億元。2021年上半年公司營收1219萬元,期內虧損3.44億元。
另外,也有觀點認為,與其將北海康成定義為罕見病藥物的研發企業,不如稱其為罕見病用藥的商業化公司,因為在北海康成現有的罕見病及罕見腫瘤產品線中,所有8個產品均來自授權引進。
“授權引進的優點是快,但缺點是貴,這樣的話定價又怎么能下得來?”另有市場分析人士指出。
高值的創新罕見病藥物,往往是企業做得起,但患者用不起;而低值的保供藥,是患者用得起,企業又“做不起”。因此,做患者用得起、企業也做得起的罕見病藥,就成了企業希望突破的另一個方向。
事實上,如果以臨床需求作為衡量指標,高值的天價罕見病藥就是為了解決病患“無藥可醫”的需求。但除此之外,罕見病的治療還存在著已有治療方案落后、高價藥品亟需更經濟的替代方案等其他需求。這部分需求在過去并不為人所關注,但又是實實在在的臨床痛點。
“很多罕見病患者需要長期或終身用藥,因此用藥順應性很重要。這個藥要安全,同時也要好吃好用,我們認為尤其是在兒童罕見病藥物的設計和研發當中,這是一個很重要的考量。”北京科信必成醫藥科技發展有限公司創新總監蔣鑫談道。
據《科創板日報》記者了解,在糖原累積癥的治療上,臨床現有主流的治療手段是服用生玉米淀粉或改良玉米淀粉,但這種治療方案存在諸多局限,包括睡前及凌晨3點必須服用,而且必須涼水調服,即使冬天也需用涼水;服用劑量大,并且淀粉經涼水沖服后體積膨脹,兒童服用一次治療量的淀粉非常困難等。
針對這樣的臨床痛點,在北京協和醫院兒科醫生提供的藥物研發思路基礎上,清華大學進行了制劑的設計,而科信必成則給予了開發資金支持以及專業系統性藥物研發的支撐,并在后期承擔起工藝改良、專利申請、動物模型構建、臨床實驗申請等工作。據悉,目前這一針對糖原累積癥治療的改良型新藥—葡萄糖緩釋微丸已進入臨床審批階段。
在采訪中,《科創板日報》記者也注意到,以臨床需求為導向的罕見病藥物研發的重要性已經被越來越多涉足這個領域的企業所認識到,這其中也包括上海醫藥。
上藥在2020年12月底成立了自己罕見病藥平臺,即上藥睿爾公司。而在怎么做罕見病藥這個問題上,上藥睿爾也有著自己的思考。
據了解,圍繞臨床需求與痛點,未來上藥睿爾的罕見病藥物開發將瞄準多個方向發力,包括針對已有治療方案過于昂貴或落后等不足而布局的仿制藥、改良型新藥產品,以及針對臨床急需但治療仍然空白的用藥需求所布局的創新藥等。
“但不管是自研還是授權引進,成本是否可控將是我們重點考慮的要素,只有成本可控,價格才可控。所以,未來在一些罕見病藥品的研發中,會充分利用上海醫藥的產業及轉化優勢,進行全產業鏈的布局,讓患者有更多的可及性選擇是我們的目標。”在日前舉行的2021年中國罕見病大會上,上藥睿爾提出。
日浙江杭州,一女子買了兩根野山參,一根20克45萬元,一根5克15萬元,拿去切片時切片師傅告訴她這個參有問題,她心里“咯噔”了一下,師傅說這個參的顏色跟其他山參不一樣,顏色偏黑偏深.
1900/1/1 0:00:00不建議買林肯飛行家,總結出來的原因有三點,1、保值率低;2、優惠力度不大;3、品牌影響力不高,消費者買一款車,看中的除了品牌之外,還有就是汽車的保值率,畢竟誰也不想剛買完新車.
1900/1/1 0:00:00數字人民幣APP自1月4日上架后,掀起一波體驗熱潮。截至1月9日,華為應用市場的數字人民幣APP下載量已從上線首日的“不足萬次”猛增至“超580萬次”.
1900/1/1 0:00:00來源:證券日報 02:56 數字人民幣App上架掀體驗潮多家平臺下載量日均增超10倍 本報記者李冰 數字人民幣App自1月4日上架后,掀起一波體驗熱潮.
1900/1/1 0:00:00天津大學2022年工程博士招生簡章 特別提醒:選擇其他學術學位專業報名無效。 招生項目: A-普通類型:面向社會和碩士應屆生;B-項目制:繼續面向與我校、學院簽訂聯合培養協議的國家重點行業、領域.
1900/1/1 0:00:00來源:智通財經APP 比特幣自去年9月以來首次跌破4萬美元,年初至今跌14%,這將是自加密貨幣誕生以來最差年度開局.
1900/1/1 0:00:00